 CAMPANHA INFECÇÃO AQUI NÃO!
CAMPANHA INFECÇÃO AQUI NÃO!EM PROTEÇÃO AO PACIENTES DE Infecções Associadas aos Cuidados de Saúde (IACS)

Staphylococcus aureus resistente à meticilina foi inicialmente descrito como um típico
microrganismo adquirido em infecções nosocomiais. No entanto, nos últimos anos
Staphylococcus aureus resistente à meticilina adquirido na comunidade é causa de
infecções de pele e tecidos moles, mas infecções graves como pneumonia e sepse
podem ocorrer. Este relato descreve um caso de sepse em criança, complicado com
pneumonia secundária a lesão em partes moles por Staphylococcus aureus resistente
à meticilina adquirido na comunidade no Sul do Brasil. O paciente foi atendido em
Unidade de Emergência com história de ferimento provocado por trauma em membro
inferior que evoluiu para celulite, pneumonia e sepse.
Prevenindo Infecções associadas aos cuidados da saúde (IACS)
Nós elaboramos uma lista de medidas preventivas que você, seus filhos, seus pais e familiares podem tomar antes, durante e depois da sua estadia no hospital para minimizar a exposição às Infecções associadas aos cuidados da saúde (IACS) e bactérias relacionadas, como SARM.
 Limpeza e higiene pessoal:
Limpeza e higiene pessoal: - Lave suas mãos. Esfregue por pelo menos 15 segundos com água morna e sabão. Use álcool-gel se você não tiver acesso a água e sabão.
- De três a cinco dias antes de sua cirurgia, tome banhos diários com sabão contendo 4% de clorexidina, disponível em farmácias.
- Quando já estiver no hospital: peça para a pessoa que te atender lavar as mãos antes de tocar em você – na sua presença. Exija isso tanto de médicos e enfermeiras que forem examiná-los quanto de visitantes que abracem, toquem ou ajudem você a se vestir, etc. Não tenha vergonha! Sua vida vale um segundo de constrangimento.
- Certifique-se que a equipe médica esfregue a área da cirurgia antes do procedimento, pois bisturis e outros instrumentos cirúrgicos arrastam as bactérias da pele para a incisão.
Equipamentos:
- Uma fonte comum de contaminação cruzada por bactérias são estetoscópios, que normalmente não são limpos após usados em cada paciente, então peça que sejam limpos – assim como qualquer outro equipamento médico – na sua presença.
- Certifique-se de que as equipes hospitalares limpem e desinfetem todas as superfícies que você deve tocar, como grades de cama, cortinas e pias. Evite colocar comida ou utensílios nos móveis ou na cama.
- Certifique-se que o cateter esteja adequadamente limpo quando inserido e removido e de que outro, novo e limpo, seja inserido a cada 3 ou 4 dias. Se alguma irritação aparecer na área em que for inserido, comunique a enfermagem imediatamente.
- Monitore ataduras e drenos e avise prontamente a enfermagem se eles estiverem soltos ou molhados.
- Evite o uso de cateteres urinários o máximo possível. Caso você precise de um, peça que seja removido de um a dois dias – o quanto antes melhor.
Exames:
- Faça um exame para verificar a presença de Staphylococcus aureus resistente à meticilina (SARM) pelo menos uma semana antes de ser internado. Você pode já ter SARM e não saber! É importante saber disso o quanto antes.
- Tenha a quantidade de açúcar sob controle se você tiver diabetes.
Medicação:
- Pergunte a seu medico sobre a administração de antibióticos antes da cirurgia. Para algumas cirurgias, você pode receber uma dosagem antes da cirurgia para prevenir uma Infecção do Sítio Cirúrgico (ISC).
Estética e Conforto:
- Se você precisa de depilação, use depiladores elétricos no dia da cirurgia em vez de lâminas, pois, com essas últimas, são maiores as chances de cortes na pele, o que aumenta a exposição às bactérias que causam infecção.
- Peça a seu médico que lhe mantenha aquecido durante a cirurgia. Obviamente, você não irá sentir frio quando anestesiado, mas estudos provaram que procedimentos simples como manter os pacientes aquecidos diminui as chances de infecção.
- Peça a quem estiver tossindo que use máscara ou que fique pelo menos dois metros longe de você, a fim de que você não pegue uma infecção transmitida pelo ar.
- Embora visitas possam animar você, se familiares e amigos não estiverem se sentindo bem, peça a eles que esperem para visitá-lo quando estiverem melhor. Converse com eles por telefone enquanto se recupera.

O Staphylococcus aureus faz parte da microbiota natural, principalmente da pele, podendo tornar-se patogênico em condições como a quebra da barreira cutânea ou diminuição da imunidade. Os traumas que comprometem a integridade da barreira cutânea constituem-se na principal causa de mudança de comportamento deste microrganismo, para o agente etiológico mais comum de infecções cutâneas1 2 6.
As infecções mais comuns envolvem a pele (celulite, impetigo) e feridas em sítios diversos. Algumas infecções por Staphylococcus aureus são agudas, piogênicas e podem disseminar para diferentes tecidos e provocar focos metastáticos. Episódios mais graves, como bacteremia, pneumonia, osteomielite, endocardite miocardite, pericardite, meningite, abscessos musculares e cerebrais, são também frequentemente documentados. Portadores nasais e pacientes colonizados por Staphylococcus aureus têm sido descritos como fator de risco para o desenvolvimento de infecções, e 11% a 43% dos pacientes colonizados adquirem infecção. O aspecto do processo infeccioso depende dos fatores de virulência do patógeno e de mecanismos de defesa do hospedeiro.
Os isolados de Staphylococcus aureus que apresentam resistência à meticilina são denominados MRSA (Methicillin-resistant Staphylococcus aureus), e representam um importante patógeno nosocomial. Vários fatores de risco estão relacionados com aquisição deste microrganismo: internação em unidade de tratamento intensivo, prolongada hospitalização, doença de base grave, procedimentos invasivos e exposição prolongada ou repetida aos antimicrobianos5 11. A resistência à meticilina é determinada pelo staphylococcal cassette chromosome mec (SCCmec), que carreia o gene mecA, o qual apresenta baixa afinidade por todos os antimicrobianos beta-lactâmicos.
Tradicionalmente, as infecções causadas por este patógeno estavam limitadas aos hospitais, porém, a partir da década passada, infecções foram descritas em todo o mundo, de forma crescente em crianças e adultos provenientes da comunidade, sem os tradicionais fatores de risco, e foram denominados de Staphylococcus aureus resistentes à meticilina associados ou adquiridos na comunidade (CA-MRSA). As síndromes clínicas causadas por estes isolados se estendem de infecções de pele e partes moles até pneumonia e sepse grave.
Os isolados de Staphylococcus aureus resistentes à meticilina associados ou adquiridos na comunidade apresentam características fenotípicas e genéticas distintas, quando comparadas às cepas típicas isoladas nos hospitais. Duas importantes características genéticas estão associadas com os isolados comunitários: a presença do SCCmec do tipo IV ou V, os quais são elementos genéticos menores e na grande maioria carream apenas resistência aos antimicrobianos beta-lactâmicos. No entanto, Staphylococcus aureus resistentes à meticilina isolados em infecções hospitalares são na maioria multidrogas resistentes e apresentam SCCmec I, II ou III7 14. A presença de genes codificadores da exotoxina leucocidina de Panton-Valentine (PVL) é outra importante característica observada nos isolados comunitários. A presença desta toxina causa necrose tecidual e destruição de leucócitos, através da formação de poros na membrana celular. A maioria dos isolados portadores deste gene está associada a infecções de pele, principalmente furúnculos e abscessos, mas pode também causar pneumonia e sepse grave.
RELATO DE CASO

Quadro clínico e exames:
Paciente masculino, 7 anos de idade, morador da região metropolitana de Porto Alegre, Sul do Brasil, foi atendido em Unidade Pediátrica de Emergência apresentando quadro séptico com dificuldade respiratória e escarro hemoptóico. Em exame físico, foi observada a presença de ferimento em membro inferior esquerdo que evoluiu para celulite. A análise laboratorial do sangue no momento da admissão revelou contagem total de leucócitos 21.040μ/l (89% neutrófilos, sendo 21% de bastonetes, 4% linfócitos, 6% monócitos e 1% eosinófilos); plaquetas 168.000/μl ; hemoglobina 11,2g/dl; velocidade de sedimentação das hemácias (VHS) 91mm; uréia 45mg/dl, creatinina 0,6mg/dl; sódio 126mEq/L e potássio 3,6mEq/L. Cultura de sangue foi realizada. Em radiografia de tórax, foi evidenciada uma imagem compatível com pneumonia bilateral. O diagnóstico clínico inicial foi de pneumonia e celulite em coxa esquerda. Foi realizada drenagem cirúrgica da celulite apresentando abscesso em membro inferior esquerdo (MIE) e em Rx dessa região foi observado comprometimento ósseo. Em hemocultura coletada no momento da admissão foi observado crescimento de um Staphylococcus aureus resistente à meticilina. O quadro evoluiu de forma grave e evidenciou-se a presença de abscesso hepático e múltiplos abscessos pulmonares, além de aneurisma de vaso pulmonar com comunicação brônquica que provocou o quadro de hemoptise. O paciente foi submetido à embolização do aneurisma, apresentando uma boa resposta. Recebeu tratamento antimicrobiano com clindamicina por
44 dias, mais 14 dias de gentamicina com boa evolução. Após 50 dias de internação, obteve alta hospitalar em bom estado clínico, com resolução completa do quadro pulmonar e hepático.
Infecções por micobactérias de crescimento rápido
resistentes a desinfetantes: uma problemática nacional !
Epidemiologia de infecções por MCR no mundo:
Casos isolados e surtos de infecções por MCR têm sido descritos em diferentes países. Os relatos descreveram casos de infecções por MCR após procedimentos precedidos por processos inadequados de esterilização de equipamentos utilizados em acupuntura, broncoscopia, cirurgias para diversas finalidades, procedimentos de hemodiálise, cateteres peritoneais e intravasculares, aplicação de piercing e contaminação de sprays de lidocaína.
A contaminação leva a quadros de infecções cutâneas em feridas operatórias, celulite, abscessos com profundidade variável em sítios anatômicos diversos, pneumonia pós-aspiração, ceratites, otite média e mastoidite, bacteremia, osteomielite linfadenites, endocardites relacionadas a cirurgias cardíacas e infecções associadas ao sistema nervoso central, como meningites1,3,4.
Dentre as formas de infecção mais recentes, foram descritos 12 casos de infecção pós-injeção intra ou periarticular de esteroides com isolamento de M. abscessus3.
Vijayaraghavan et al.5 descreveram, em 2006, uma série de 145 infecções de ferida operatória por M. chelonae em 35 pacientes submetidos à cirurgia de videolaparoscopia em uma mesma unidade de saúde durante seis meses. A fonte de contaminação foi a água utilizada na etapa de rinsagem dos instrumentos a serem desinfetados. Os micro-organismos sobreviviam e cresciam no biofilme formado no fundo dos recipientes contendo os desinfetantes. A alteração dos procedimentos de desinfecção, como a utilização de óxido de etileno, foi suficiente para impedir a continuidade do surto, já que esses micro-organismos eram resistentes à autoclavação, esterilização com vapores de formaldeído e desinfecção química com GA5.
Os procedimentos invasivos ginecológicos relacionados a infecções por MCR incluem casos relacionados ao implante de próteses mamárias e mastectomia, sem evolução para sintomas sistêmicos e não são estritamente associadas às comorbidades6. Os casos descritos estavam associados unicamente às espécies M. chelonae e M. fortuitum. Hipóteses relacionando o risco de infecções com o tipo de prótese (lisa, texturizada, poliuretano), preenchimento (salina ou gel) e marca do produto não foram comprovadas devido ao não-isolamento dos micro-organismos a partir desses produtos. Soluções para irrigação com composições distintas, incluindo bacitracina, iodo-povidine a 10%, salina estéril a 0,9%, assim como agentes utilizados na degermação da pele, incluindo solução de gluconato de clorexidina a 4% e iodo-povidine a 10%, foram utilizadas nos procedimentos cirúrgicos nos casos confirmados6. O uso de expansores reaproveitados e óticas para a colocação da prótese mamária por via axilar poderia também estar associado. Porém, a comprovação da relação epidemiológica não foi possível devido ao descarte ou reprocessamento do material antes do início dos sintomas. Nenhum relato relacionado ao procedimento invasivo obstétrico foi divulgado em publicações internacionais.
Os surtos de infecções por outras espécies de MCR são raros e publicações recentes indicam possível emergência de espécies como M. massiliense, M. mucogenicum e M. phocaicum em quadros clínicos respiratórios, de infecção local ou disseminada após procedimentos invasivos.
Epidemiologia de infecções por MCR no Brasil :
No Brasil, as infecções nosocomiais ou relacionadas aos cuidados com a saúde representam um problema emergente, porém são raras as investigações, relatos de casos e surtos por MCR. Em sua maioria, os estudos de surtos apresentam evidência de procedimentos inadequados de esterilização e/ou desinfecção, criando condições favoráveis à ocorrência desses eventos. As espécies mais frequentemente citadas consistiam de M. abscessus, M. chelonae, M. fortuitum e M. immunogenum8,9. Em 1988 e 1999 foram diagnosticados dois casos de ceratite por M. abscessus após cirurgia a laser (LASIK – laser in situ keratomieleusis) para correção de miopia em uma mesma clínica. Em 1999, 22 pacientes em outra clínica na cidade do Rio de Janeiro também apresentaram ceratite com diagnóstico laboratorial de infecção por M. chelonae, mas não foi determinada sua fonte de infecção. No ano 2000, outro novo surto de ceratite após LASIK, causada por M. chelonae, envolvendo dez pacientes em uma única clínica em São Paulo foi descrito. O micro-organismo foi também isolado do filtro do ar condicionado da sala de cirurgia e da água do reservatório do vaporizador utilizado para a limpeza do cerátomo. No mesmo ano foram diagnosticados abscessos cutâneos em pacientes submetidos à
mesoterapia em uma clínica na cidade de São Paulo. O tratamento consistia de cinco a dez sessões envolvendo injeções intradérmicas. O M. chelonae foi identificado como o agente etiológico em dez pacientes.
Dentre os surtos relacionados a procedimentos cirúrgicos não-oftalmológicos, Padoveze et al. descreveram um surto envolvendo 50 casos suspeitos (14 confirmados) de infecções de pele e subcutâneo por M. abscessus, M. fortuitum e M. porcinum após procedimentos cirúrgicos de implante de prótese de silicone em Campinas, entre 2002 e 200410. Sampaio et al.9 complementaram a descrição desse evento por estudos de caracterização da diversidade genética dos micro-organismos isolados, mas a fonte de transmissão não foi identificada.
Desde 2004, a Agência Nacional de Vigilância Sanitária tem divulgado a ocorrência de 15 surtos isolados de MCR associados a cuidados com a saúde em várias Unidades Federadas brasileiras, incluindo Distrito Federal, Espírito Santo, Goiás, Mato Grosso, Pará, Rio Grande do Sul, Rio de Janeiro e São Paulo. Os números de casos variam entre as diversas localidades, com uma média de 50 casos em 2007. No entanto, houve 310 casos acumulados nos últimos quatro anos no Estado do Pará; 1.051 casos notificados no Estado do Rio de Janeiro, e mais de 2.000 casos confirmados em todo o território nacional. Os surtos relacionados aos procedimentos cirúrgicos envolvem principalmente aqueles em que os os instrumentos médicos foram desinfetados com soluções de GA11.
Os estudos que descreveram os aspectos moleculares das cepas isoladas nos recentes surtos de infecções após procedimentos invasivos incluem a caracterização das cepas de MCR isoladas em Belém, durante o surto no período de 2004 a 2005 pela técnica de PFGE12. Nesse estudo descritivo foi verificado que as cepas isoladas de biópsia após procedimentos mesoterápicos consistiam em M. bolletii pertencentes a vários clones, e aquelas provenientes de infecções pós-cirúrgicas em várias instituições pertenciam à espécie M. massiliense, distribuídas em um clone, sugerindo fonte única de transmissão.
Cardoso et al.13 caracterizaram com técnicas moleculares as cepas isoladas de surtos de infecções após procedimentos videocirúrgicos, especialmente artroscopia, em Goiânia. Nesse estudo também foram detectadas 18 cepas de M. massiliense, a qual pertence a um único clone e com aspectos similares aos descritos no estudo anterior.
Em publicações recentes do laboratório utilizado para o presente artigo, foram caracterizados os aspectos microbiológicos da epidemia recente de infecções após procedimentos videolaparoscópicos no Estado do Rio de Janeiro14. De Agosto de 2006 a Julho de 2007, 1.051 casos suspeitos foram notificados em 63 hospitais. As infecções estavam relacionadas à realização de procedimentos videolaparoscópicos e acometeram principalmente a pele e o tecido celular subcutâneo. Os pacientes apresentavam como principais manifestações clínicas a formação de abscessos, nódulos e ulcerações nos sítios de incisão, e não respondiam ao tratamento antimicrobiano padrão para infecções do sítio cirúrgico. A partir dos casos com confirmação por cultura, o Mycobacterium massiliense foi identificado em 97,2% dos casos. Verificou-se a existência de um clone de M. massiliense entre os casos confirmados, denominado BRA100, o mesmo clone encontrado e caracterizado nos surtos de Belém e Goiânia.
Procedimentos associados à infecção e fatores de risco
possíveis :
De acordo com norma vigente, os artigos cirúrgicos utilizados nos procedimentos laparoscópicos eram submetidos à desinfecção de alto nível pela imersão em solução de GA a 2% por 30 minutos. Apesar da inexistência de estudos epidemiológicos precisos envolvendo fatores de riscos para os diferentes surtos, a utilização de GA a 2% de origem comercial deve ser considerada como de suma importância, pois soluções comerciais contendo esses compostos, como base ativa, foram utilizadas em 100% dos hospitais que apresentaram casos suspeitos e confirmados no procedimento pré-operatório. No intuito de investigar a hipótese de tolerância ou não suscetibilidade das cepas do surto a esse agente, foram realizados estudos experimentais, utilizando cepas obtidas diretamente dos casos confirmados e cepas de referência de coleções como as do Instituto Nacional de Controle de Qualidade e American Type Culture Collection. Com esse procedimento, foi comprovada particular tolerância do clone BRA100 pertencente à espécie M. massiliense a diferentes soluções comerciais de GA a 2%, mesmo após 30 minutos, 1, 6 e 10 horas de exposição14,15. Cepas com características semelhantes não foram descritas em outros países.
De acordo com as investigações realizadas durante a epidemia no Estado do Rio de Janeiro, envolvendo 63 hospitais com casos notificados, diversos aspectos inadequados na prática pré-operatória foram observados em relatórios de supervisores e equipes médicas envolvidas em diferentes hospitais14. Dentre estes pontos, podem ser citados: ausência de registros efetivos de soluções de GA comerciais utilizadas na desinfecção de alto nível quanto à marca, tempo de imersão dos instrumentos, validade, confirmação da concentração e pH, presença ou não de matéria orgânica; não-utilização de recipientes adequados para armazenamento das soluções em uso e processo de desinfecção; ausência de uniformidade quanto ao profissional responsável pela limpeza e desinfecção e carência de treinamento específico; ausência de procedimentos operacionais padrão e/ou protocolos com detalhes das condutas a serem aplicadas na limpeza e desinfecção; reutilização de material descartável; ausência de controle microbiológico do funcionamento das autoclaves ou investigação microbiológica do instrumental por amostragem e inadequado sistema de vigilância de infecções pós-cirúrgicas.
Considerando os aspectos apresentados, é fundamental ressaltar que a presença em ambientes hospitalares ou clínicas, e a possível disseminação das cepas de M. massiliense pertencentes ao clone BRA100, as quais apresentaram comprovada tolerância/resistência a desinfetantes como GA a 2%, consistem em fatores de risco primordiais para as infecções pós-cirúrgicas14,15.
Com base nestes achados e de forma a prevenir a ocorrência de novos surtos, foi publicada recentemente a suspensão cautelar do uso de GA a 2% como desinfetante ou esterilizante líquido para artigos críticos, pela Secretaria de Estado de Saúde do Rio de Janeiro (Resolução SESDEC nº 431, de 29 de agosto de 2008), e a proibição de esterilização química líquida pela Agência Nacional de Vigilância Sanitária (Resolução da Diretoria Colegiada – RDC no 8, de 27 de fevereiro de 2009), sem a existência de alternativas imediatas respaldadas pelo conhecimento científico.
Perspectivas
Dentre os aspectos recentes envolvendo as MCR relacionadas aos surtos recentes no Brasil, estão sendo concluídos os estudos de avaliação da suscetiblidade do clone BRA100 de M. massiliense a desinfetantes diversos, como ortoftaldeído (OPA) e o ácido peracético, de forma a propor novas alternativas para desinfecção de instrumentais médicos ou odontológicos termossensíveis para contribuir à adequação de medidas proibitivas para o uso de soluções desinfetantes. Adicionalmente, é importante ressaltar a nova proposta de reclassificação taxonômica das espécies M. massiliense e M. bolletii como subespécies de M. abscessus, devido à alta similaridade fenotípica e genética entre esses micro-organismos.
Infecções associadas aos cuidados da saúde (IACS)
Representam uma crise global que afeta tanto pacientes quanto trabalhadores de serviços de saúde. Financeiramente, as IACS representam um impacto anual estimado em $6,7 bilhões para as instituições para serviços de saúde, mas os custos humanos são ainda maiores. Um relatório do Centro de Controle de Doenças (CDC) publicado em março-abril de 2007 estimou em 98,987 o número de mortes nos EUA causadas por infecções associadas aos cuidados da saúde no ano de 2002. No entanto, provavelmente esse número é ainda maior, pois os autores do estudo ressaltam, "Nenhuma fonte de dados nacionalmente representativa sobre as IACS está disponível no momento. 1
De acordo com a Organização Mundial de Saúde, "Em um dado momento 1,4 milhões de pessoas estão sofrendo de uma infecção adquirida em uma instituição de saúde. O risco de se adquirir infecções associadas aos cuidados da saúde em países em desenvolvimento é de 2 a 20 vezes maior do que em países desenvolvidos.2
Até recentemente, a falta de requerimentos de relatórios sobre IACS para instituições para serviços de saúde contribuiu para uma baixa atenção dedicada a eliminação das fontes de infecções associadas aos cuidados da saúde. No entanto, a crescente preocupação pública em relação ao assunto e a resultante legislação em nível estatal e local exigindo responsabilidade estão ajudando a acelerar as iniciativas para combater as IACS.
Doenças Infecciosas em Ambientes para Cuidados de Saúde
O CDC relata que as seguintes doenças infecciosas podem ser transmitidas e/ou adquiridas em ambientes para cuidados de saúde e por isso são possíveis Infecções Associadas aos Cuidados da Saúde (IACS).
Acinetobacter
|
Patogênicos Transmitidos pelo Sangue
|
Burkholderia cepacia
|
Varicela
|
Clostridium difficile
|
Clostridium sordellii
|
Doença de Creutzfeldt-Jakob
|
Ebola (Febre Hemorrágica Viral)
|
Infecções Gastrointestinais
|
Hepatite A
|
Hepatite B
|
Hepatite C
|
HIV/AIDS
|
Gripe
|
SARM - Staphylococcus Aureus Resistente à Meticilina
|
Caxumba
|
Norovírus
|
Parvovírus
|
Poliovírus
|
Pneumonia
|
Rubéola
|
SRAG
|
S. pneumoniae (resistente a drogas)
|
Tuberculose
|
Varicela
|
Febre Hemorrágica Viral (Ebola)
|
VISA - Staphylococcus Aureus Vancomicina-Intermediário
|
VRE - Enterococo resistente à Vancomicina
|
Data da Última Alteração: 22 de maio de 2006
1. Relatórios da Saúde Pública / Março e Abril de 2007 / Volume 122, p.160
2. Aliança Mundial pela Segurança do Paciente, Desafio Global para a Segurança do Paciente 2005-2006: Cuidado Limpo é Cuidado mais Seguro. Genebra: Organização Mundial de Saúde, 2005
Há três grandes categorias que representam uma porcentagem significativa das IACS. Clique nos links abaixo para saber mais sobre cada uma delas:
 |
|
 |
|
 |
|

Infecções do Sítio Cirúrgico (ISC)
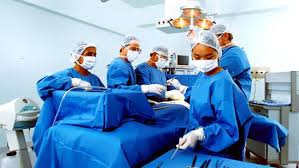
Iniciadas durante procedimentos invasivos podem necessitar de tratamento adicional e/ou prolongado. Apesar dos melhores esforços das instituições para serviços de saúde para manter os ambientes cirúrgicos seguros, as infecções do sítio cirúrgico resultam em custos de tratamento de até $10 bilhões de dólares todos os anos somente nos EUA.
- Aproximadamente 780.000 de 30 milhões de procedimentos cirúrgicos realizados anualmente nos EUA resultam em ILC.1
- No Reino Unido, os custos diretos estimados para um paciente que desenvolveu uma infecção do sítio cirúrgico são entre €2,265 e €2,518.2
- De acordo com um estudo realizado na Holanda, as ILCs resultam entre 5.8 e 17 dias extras de hospitalização.3
- Na França, aproximadamente 11% dos pacientes cirúrgicos adquirem uma infecção do sítio cirúrgico.4
Alguns casos comuns de ILC são:
- Complicações de hipotermia cirúrgica
- Contaminação da área de incisão pela flora cutânea
- Contaminação cruzada bacteriana
- Contaminação por instrumento cirúrgico
Diversos fatores aumentam a incidência de ISC: alguns tipos de cirurgias, como cirurgias
cardíacas e queimados; cirurgias realizadas em grandes hospitais, pacientes adultos em
comparação com pediátricos e a quantidade de inóculo bacteriano introduzido no ato
cirúrgico. Com base em estudos que demonstraram a positividade de culturas do intraoperatório
como um preditor de infecção, as cirurgias são classicamente categorizadas
segundo o seu potencial de contaminação, com o objetivo de estimar a probabilidade da
ocorrência de ISC.
Diagnóstico
Clinicamente, a ferida cirúrgica é considerada infectada quando existe presença de
drenagem purulenta pela cicatriz, esta pode estar associada à presença de eritema, edema,
calor rubor, deiscência e abscesso. Nos casos de infecções superficiais de pele, o exame da
ferida é a principal fonte de informação; em pacientes obesos ou com feridas profundas em
múltiplos planos (com após toracotomia) os sinais externos são mais tardios.
O diagnóstico epidemiológico das ISC deve ser o mais padronizado possível para permitir
a comparação ao longo do tempo em um determinado serviço e também a comparação entre
os diversos serviços e instituições. Para isto, o Center for Diseases Control and Prevention
(CDC), nos EUA, criou definições de ISC que são mundialmente usadas para vigilância
epidemiológica:
Infecção de Sítio Cirúrgico Incisional Superficial
Deve ocorrer em 30 dias após o procedimento e envolver apenas pele e tecido
subcutâneo e apresentar pelo menos um dos seguintes sinais ou sintomas:
1. Drenagem de secreção purulenta da incisão
2. Microrganismo isolado de maneira asséptica de secreção ou tecido
3. Pelo menos um dos sinais e sintomas e a abertura deliberada dos pontos pelo
cirurgião exceto se cultura negativa: dor, edema, eritema ou calor local.
4. Diagnóstico de infecção pelo médico que acompanha o paciente
Infecção do Sítio Cirúrgico Incisional Profunda
Deve ocorrer em 30 dias após o procedimento se não houver implante ou um ano
se houver implante. A infecção deve envolver os tecidos moles profundos (músculo
ou fascia) e apresentar pelo menos um dos seguintes sinais ou sintomas:
1. Drenagem purulenta de incisão profunda
2. Incisão profunda com deiscência espontânea ou deliberadamente aberta pelo
cirurgião quando o paciente apresentar pelo menos um dos sinais ou
sintomas: febre, dor localizada, edema e rubor exceto se cultura negativa.
3. Abscesso ou outra evidencia de infecção envolvendo fascia ou músculo,
achada ao exame direto, re-operação, histopatológico ou radiológico.
4. Diagnóstico de infecção incisional profunda pelo médico que acompanha o
paciente.
Infecção de órgão/espaço
Deve ocorrer em 30 dias após o procedimento se não houver implante ou um
ano se houver implante. Envolver qualquer outra região anatômica do sitio cirúrgico
que não a incisão e apresentar pelo menos um dos seguintes sinais ou sintomas:
1. Drenagem purulenta por dreno locado em órgão ou cavidade
2. Microrganismo isolado de maneira asséptica de secreção ou tecido de órgão
ou cavidade
3. Abscesso ou outra evidencia de infecção envolvendo órgão ou cavidade
achada ao exame direto, reoperação, histopatológico ou radiológico.
4. Diagnóstico de infecção de órgão/espaço pelo médico que acompanha o
paciente.
paciente.
Agentes Etiológicos
A fonte mais freqüente é a flora endógena do paciente; estima-se que após 24hs do
procedimento a ferida cirúrgica está selada e, portanto, protegida da contaminação
exógena. Infecções à distância podem ser fonte de microorganismos que contaminam a ferida cirúrgica e devem ser pesquisados e tratados no pré-operatório de cirurgias eletivas.
Fontes exógenas podem ter importância durante o ato cirúrgico, portanto uma rigorosa técnica asséptica deve ser mantida com intuito de prevenir a contaminação.
O ar pode ser veículo de transmissão de alguns patógenos em casos especiais, como por exemplo, casos de infecção por Streptococcus do grupo A transmitida por pessoas da equipe cirúrgica. Estratégias como as salas cirúrgicas com fluxo laminar e/ou radiação ultravioleta
só foram eficazes em reduzir as taxas de ISC em cirurgias para colocação de prótese de quadril ou joelho.
Os agentes mais freqüentes de ISC são os contaminantes comuns da pele do paciente:Staphylococcus aureus, Staphylococcus epidermidis e outros Staphylococcus coagulase negativa. Em cirurgias abdominais existe uma maior freqüência de enterobactérias e Enterococcus sp. Na faixa etária pediátrica e em recém nascidos as enterobactérias são mais freqüentemente encontradas do que em pacientes adultos. Em queimados, o S.aureus é o agente mais comum seguido da Pseudomonas aeruginosa. A incidência de bactérias Gram-negativas e Enterococcus sp aumenta com o tempo de internação. A incidência de
fungos vem crescendo devido ao grande número de pacientes imunodeprimidos, entre eles,as espécies de Candida, principalmente albicans e tropicalis são os agentes mais comuns.
Fatores de Risco
O risco de ocorrência de ISC é determinado por: a) dose do inóculo microbiano no sítio cirúrgico; b) virulência do microrganismo; c) resistência imunológica do hospedeiro; d)status fisiológico do sítio cirúrgico no final da cirurgia, que é influenciado pela quantidade de tecido desvitalizado, técnica cirúrgica empregada e doença de base do paciente.
Os fatores de risco referentes ao hospedeiro são:
• Diabetes mellitus - um controle glicêmico adequado no pré-operatório e no intraoperatório é recomendável; o controle glicêmico no pós-operatório facilita a cicatrização e diminui o tempo de internação.
• Tabagismo – o paciente deve ser orientado no pré-operatório a parar de fumar ou
diminuir o uso de qualquer forma de consumo de tabaco
• Obesidade – dificulta a cicatrização e a concentração tecidual adequada do antibiótico profilático
• Perda rápida e recente de peso - pode ser um fator de risco principalmente por estar
associada à desnutrição
• Desnutrição – se possível postergar a cirurgia para que o paciente melhore o estado
nutricional, a albumina pode ser um bom marcador para controle.
• Idade avançada
• Imunossupressão – secundária ao uso de corticóide ou outros imunossupressores ou a doença de base, contudo, não existe consenso sobre a eficácia em reduzir a
imunossupressão para realização de procedimentos para controle de ISC.
• Infecções de sítios distantes - devem ser pesquisadas e tratadas no pré-operatório.
Os fatores de risco relacionados à assistência pré-operatoria são:
• Tempo de internação pré-operatório – principalmente se o paciente estiver em
Unidade de Terapia Intensiva. A internação pré-operatória prolongada favorece a
substituição da flora endógena do paciente, aumentando o risco de aquisição de
microrganismos multi-resistentes.
• Tricotomia extensa – principalmente se os pêlos forem raspados, pois este
procedimento produz micro lesões que aumentam a colonização da pele e dificultam a antisepsia da mesma. Quanto mais precoce a tricotomia, maior o risco.
Os fatores relacionados ao intra-operatório são:
• Tempo intra-operatório prolongado – por aumentar o risco de contaminação da ferida, aumentar a lesão tecidual, aumentar a imunossupressão por perda de sangue, diminuir o
efeito do antibiótico profilático quando não repicado e aumentar o número de suturas e uso do cautério.
• Técnica cirúrgica como: manipulação intensa, abertura inadvertida de víscera,
controle inadequado de sangramento, espaço morto, quantidade de tecido desvitalizado.
• O uso de drenos – por permitir a migração retrógrada de bactérias da flora da pele
Prevenção
São três as principais estratégias para reduzir e prevenir as ISC:
• Diminuir o montante e o tipo de contaminação
• Melhorar as condições da ferida
• Melhorar as defesas do hospedeiro
A antibioticoprofilaxia deve ser realizada antes do inicio da cirurgia para que no
momento da incisão da pele exista concentração tecidual adequada. Como S.aureus é o
agente mais freqüente de infecção a profilaxia deve ser realizada com antibióticos com
atividade para este agente, geralmente cefalosporinas de primeira e segunda geração. Caso
a cirurgia seja prolongada, existe uma grande perda volêmica ou o paciente for obeso
mórbido é recomendável uma segunda dose intra-operatória. O uso de antibiótico
profilático que tem início no pós-operatório imediato e se estende por longos períodos não
previne nem cura a inflamação ou infecção.
Os mais atuais guias para prevenção das infecção hospitalar são baseados em evidências
científicas e categorizam as suas recomendações de acordo com a força destas evidências.
O CDC classifica suas recomendações de acordo com as seguintes categorias:
Categoria IA: são medidas fortemente recomendadas para implementação e
fortemente suportadas por estudos experimentais, clínicos ou epidemiológicos bem
desenhados.
Categoria IB: são medidas fortemente recomendadas para implementação e
suportadas por alguns estudos experimentais, clínicos ou epidemiológicos e com
forte razão teórica.
Categoria IC: são medidas determinadas por regulamentações, normas ou padrões
governamentais.
Categoria II: são medidas sugeridas para implementação e são suportadas por
estudos clínicos ou epidemiológicos indicativos e com uma razão teórica.
Tópicos não resolvidos ou sem recomendações: são medidas para as quais as
evidências científicas são insuficientes ou não há consenso relativo a sua eficácia.

Infelizmente, até mesmo com as melhores das intenções, os trabalhadores de serviços de saúde nem sempre lavam e desinfetam suas mãos com a frequencia que deveriam. Esta higiene insuficiente das mãos pode representar um sério risco para os pacientes, pois como declarado pela Dra. Julie Gerberding, diretora do Centro de Controle de Doenças (CDC), "Mãos limpas representam o fator único e mais importante para prevenir a propagação de germes perigosos e a resistência a antibióticos nos ambientes para cuidados de saúde."
Assim como o uso de luvas não elimina a necessidade de higiene das mãos, o uso de higiene das mãos não elimina a necessidade de luvas. As luvas reduzem a contaminação das mãos de 70 a 80 por cento, previnem a contaminação cruzada e protegem os pacientes e o pessoal ligado aos cuidados da saúde contra infecções.

A importância de luvas, máscaras e outros equipamentos de proteção individual não pode ser supervalorizada na prevenção de infecções em ambientes para cuidados de saúde. Ao lado da higiene das mãos, estes itens compõem a primeira linha de defesa para prevenir a propagação da infecção de pessoa para pessoa dentro dos ambientes para cuidados de saúde.
O ato de lavar as mãos é o principal meio de prevenção de infecções dentro do ambiente hospitalar. A lavagem das mãos evita, portanto, as infecções cruzadas do funcionário para com o paciente, do funcionário para outro funcionário, de paciente para funcionário e de funcionário para visitantes. As mãos abrigam a microbiota bacteriana transitória e a residente.
Quando se lavam as mãos (com a técnica correta), eliminam-se bactérias da microbiota transitória e parte da residente, removendo microrganismos, células descamativas, sujidades e oleosidade da pele.
Para evitar que funcionários sejam fonte de contaminação, deve-se evitar o cumprimento de funcionário, paciente e visitante com as mãos sem a lavagem prévia; abrir ou fechar a porta do quarto do paciente com as mãos não lavadas e limpar o mobiliário do paciente sem o uso de luvas. Deve-se, portanto, lembrar que as luvas também são fontes de contaminação, devendo ser usadas com técnica e bom senso. É preciso lavar as mãos antes e após cada procedimento realizado, atos e funções fisiológicas, as refeições e o uso de luvas. Para a lavagem das mãos é necessário que haja pias. Estas deverão ser instaladas em quantidade suficiente, para que se economize tempo, movimento e energia do funcionário.
Quando se lavam as mãos (com a técnica correta), eliminam-se bactérias da microbiota transitória e parte da residente, removendo microrganismos, células descamativas, sujidades e oleosidade da pele.
Para evitar que funcionários sejam fonte de contaminação, deve-se evitar o cumprimento de funcionário, paciente e visitante com as mãos sem a lavagem prévia; abrir ou fechar a porta do quarto do paciente com as mãos não lavadas e limpar o mobiliário do paciente sem o uso de luvas. Deve-se, portanto, lembrar que as luvas também são fontes de contaminação, devendo ser usadas com técnica e bom senso. É preciso lavar as mãos antes e após cada procedimento realizado, atos e funções fisiológicas, as refeições e o uso de luvas. Para a lavagem das mãos é necessário que haja pias. Estas deverão ser instaladas em quantidade suficiente, para que se economize tempo, movimento e energia do funcionário.
Como lavar as mãos



Retirar jóias (anéis, pulseira, relógio), uma vez que nesses objetos acumulam-se bactérias não removíveis com a lavagem das mãos.
Abrir a torneira com a mão dominante sem encostar na pia, para não contaminar a roupa, quando não houver pedal.
Molhar as mãos.
Aplicar 3 a 5 ml de sabão líquido nas mãos.
Ensaboar as mãos, formando espuma friccionando-as por 15 a 30 segundos, atingindo todas as suas faces (palma, dorso, espaços interdigitais, articulações, unhas e extremidades dos dedos).
Enxaguar, deixando a água penetrar nas unhas e espaços interdigitais (mão em forma de concha). Retirar toda a espuma e os resíduos de sabão, sem deixar respingar água na roupa e no piso. A formação de espuma extrai e facilita a eliminação de partículas.
Secar as mãos com papel toalha descartável (duas folhas). Se a torneira for manual, usar o mesmo papel toalha para fechá-la.
Desprezar o papel toalha na lixeira.
 Infecção Hospitalar (IH)
Infecção Hospitalar (IH) “É qualquer processo infeccioso adquirido no ambiente hospitalar, diagnosticado principalmente durante sua internação, mas que pode ser detectado após a alta e atingir também qualquer outra pessoa presente no hospital” (HINRICHSEN, Sylvia L.,2004). São infecções relacionadas à hospitalização de um paciente ou aos procedimentos diagnósticos e terapêuticos praticados. A infecção hospitalar é, em sua maioria, endógena e independe do meio ambiente.
A infecção comunitária é aquela constatada ou em incubação na admissão do paciente, desde que não relacionada com internação anterior no mesmo hospital. Indivíduos que trabalham em hospitais estão potencialmente expostos a uma diversidade de doenças infecto-contagiosas e podem adquirir infecção hospitalar. Este tipo de infecção diz-se ocupacional.
Infecções hospitalares são, pois, complicações infecciosas relacionadas à assistência prestada ao paciente e à diminuição de sua capacidade de defesa antiinfecciosa e podem ser endógenas, exógenas, cruzadas e inter-hospitalares.
Infecção endógena é a que se verifica a partir de microrganismos do próprio paciente, geralmente imunodeprimido, e que corresponde a aproximadamente 2/3 das infecções hospitalares. Infecção exógena é a que se verifica a partir de microrganismos estranhos ao paciente, sendo veiculada pelas mãos da equipe de saúde, nebulização, uso de respiradores, vetores, por medicamentos ou alimentos contaminados. Infecção cruzada é a que se transmite de paciente a paciente, geralmente pelas mãos da equipe de saúde. Infecção inter-hospitalar é um conceito que foi criado para definir as infecções hospitalares que são levadas de um hospital para outro com a alta e subseqüente internação do mesmo paciente em diferentes hospitais.
Os agentes etiológicos mais comumente encontrados nos processos infecciosos são as bactérias. Entretanto, fungos, vírus ou protozoários, na dependência da infecção, tipo e gravidade da doença de base do paciente, assim como dos antibióticos usados previamente e do tempo de hospitalização, podem ser igualmente freqüentes e graves.
Em hospitais gerais, os pacientes com maior risco de contrair IH são os neutropênicos, os submetidos a cirurgia, os internados em UTI, os politraumatizados e os grandes queimados. As infecções hospitalares podem localizar-se em qualquer sítio do organismo, dependendo dos fatores que precipitaram ou facilitaram a infecção. As infecções urinárias e respiratórias são as mais freqüentes em hospitais gerais.
A porta de entrada pode ser a via digestiva, a pele, a conjuntiva ou o trato geniturinário. A suscetibilidade à infecção está relacionada ao patrimônio genético, à idade, à inibição dos mecanismos de defesa naturais e/ou adquiridos, à integridade anatômica dos tecidos e, em alguns casos, ao sexo.
A freqüência das complicações infecciosas hospitalares varia de acordo com a causa da internação, o estado do paciente e o tipo de assistência que recebe.

Caracterização da Infecção Hospitalar
Para se definir e classificar a origem do processo infeccioso hospitalar, é necessário identificar em cada paciente o que o levou a adquirir a infecção; quais os fatores de risco preexistentes, quais os sintomas e quando se iniciaram, quais os procedimentos realizados e se houve intercorrências e qual o tipo de ferida cirúrgica. Toda uma conjuntura deve ser analisada para identificar o processo e sua causas.
Os germes Gram-negativos (Klebsiella sp.; Enterobacter sp.; Serratia sp.; Proteus sp.; E. coli; Pseudomonadacea (principalmente P. Aeruginosa, Acinetobacter), são freqüentes causadores de infecções hospitalares e, geralmente, são adquiridos por meios de mãos contaminadas, que servem de reservatório e vetor destas bactérias. O risco de contaminação por esta via é maior mesmo para pacientes com defesas secundárias preservadas. O hábito de lavar as mãos antes e após cada procedimento, e entre os cuidados de um paciente e outro, reduz significativamente a incidência de infecções.
A pele e as mucosas representam a primeira linha de defesa do corpo contra o meio externo, servindo como barreiras e assumindo importância ainda maior quando as defesas secundárias estão alteradas. A rica vascularização da pele facilita a disseminação de microrganismos para outros locais e também sua contaminação a partir de infecções sistêmicas. Os principais mecanismos que determinam a destruição da barreira cutânea são: o trauma produzido pela introdução de agulhas ou catéteres intravasculares; a utilização de curativos oclusivos com materiais impermeáveis que aumentam a hidratação da pele, alterando a composição da biota bacteriana residente e o uso de agentes microbianos e corticosteróides tópicos e/ou sistêmicos.

Bactérias Gram-negativas resistentes a drogas de primeira linha (aminoglicosídeos e cefalosporinas) têm sido observadas no ambiente hospitalar e, eventualmente, em infecções comunitárias, especialmente os gêneros Klebisiella, Serratia e Enterobacter. São bactérias que colonizam o trato gastrointestinal e a pele dos pacientes, sendo veiculadas pelas mãos. Em geral, são pouco exigentes do ponto de vista nutricional, podendo contaminar e proliferar em ambientes úmidos, pouco nutritivos (líquidos de infusão, circuitos de respiradores, nebulizadores, alimentos e dietas enterais).
O diagnóstico das infecções hospitalares deverá valorizar informações oriundas de evidência clínica derivada da observação direta do paciente ou da análise de seu prontuário; resultados de exames de laboratório, ressaltando-se os exames microbiológicos, a pesquisa de antígenos, anticorpos e métodos de visualização realizados; evidências de estudos com métodos de imagem, endoscopia, biópsia e outros.
Fonte: http://www.webartigos.com/articles/10027/1/A-Higienizacao-Das-Maos-No-Controle-Da-Infeccao-Hospitalar/pagina1.html#ixzz174TTCNt2

É uma das três principais infecções que mais preocupam os clínicos atualmente; ela pode ser responsável por até 60% de todas as mortes causadas por infecções associadas aos cuidados da saúde (IACS) nos EUA.1 Outras estatísticas importantes dos EUA incluem:
- Aproximadamente de 8 a 28% dos pacientes de cuidados intensivos desenvolvem VAP2
- Pacientes com pneumonia associada aos cuidados da saúde têm uma taxa de mortalidade de 20% a 33%1
- A VAP aumenta o tempo que os pacientes passam na UTI em 4 a 6 dias1
- Para cada incidência de VAP estima-se um aumento de custos de $20.000 a $40.0001
A VAP é um problema mundial. Na Alemanha, entre 2001 e 2005, 5,72% dos pacientes de UTI desenvolveram VAP.3 De acordo com estatísticas recentes, 9,2% dos pacientes de UTI na França desenvolvem pneumonia adquirida em UTIs.4 E no Reino Unido, as infecções das vias respiratórias inferiores adquiridas em hospitais acrescentam uma média de 12 dias de hospitalização, com uma média de custos adicionais de $4.149 por paciente.5
O Sistema Nacional de Vigilância de Infecções Nosocomiais (NNIS) do CDC relatou que em 2002, os pacientes que recebiam ventilação mecânica contínua tinham entre 6 e 21 vezes mais riscos de desenvolver pneumonia associada à ventilação mecânica quando comparados a pacientes que não recebiam ventilação mecânica. Por causa deste enorme risco, nas últimas duas décadas, a maioria das pesquisas sobre pneumonia associada aos cuidados da saúde esteve focada em VAP.
Agentes etiológicos

imagem do Staphylococcus aureus
Os principais agentes causadores desta infecção são: Staphylococcus aureus,Pseudomonas aeruginosa, e Enterobacteriaceae. Estes se diferenciam de acordo com os pacientes em uma UTI, duração de permanência na mesma e uma precoce terapia antimicrobial18.
Foi realizado um estudo onde pôde-se observar que a PN precoce em uma UTI teve incidência de 56,6%, ocorrendo até o quarto dia de internação, e apresentou como agentes etiológicos mais freqüentes o Acinectobacter spp. e o Staphylococcus aureus. Nesse estudo a taxa de mortalidade da pneumonia foi de 45,7%3.
Outra pesquisa foi feita com a finalidade de determinar o impacto dos microorganismos multirresistentes na morbi-mortalidade de pacientes com PAVM. Esta surgiu em 91 pacientes, e em 82,4% dos casos foram causados por microorganismos multirresistentes, onde oStaphylococcus aureus foi o causador de 27,5% dos casos de PAVM e a Pseudomonas aeruginosa por 17,6%. A PAVM foi de início recente em 36,3% e de início tardio em 63,7%. Em 56% dos pacientes com pneumonia por microorganismo multirresistente o tratamento empírico foi inadequado. Houve mortalidade de 61,3% dos pacientes com a pneumonia por patógenos multirresistentes.
Tratamento clínico e prevenção

A maioria dos casos a morte por pneumonia ocorre por uma antibioticoterapia inadequada. Portanto, a escolha do antibiótico correto se torna uma estratégia importante na redução da mortalidade desses pacientes. Para realizar uma antibioticoterapia adequada deve-se considerar vários fatores além de uma simples combinação de antibióticos com as bactérias, é preciso administrar o medicamento certo na dose certa, prevenindo a ocorrência de patógenos multirresistentes, que está relacionada à dois fatores importantes, o uso prévio da antibióticos e a duração da VM. É importante usar a terapia empírica adequada o mais rápido possível, e é necessário o conhecimento de quais patógenos estão presentes na UTI de cada hospital, assim como sua sensibilidade, evitando-se o uso excessivo de antibióticos23.
Para o tratamento da PAVM o esquema de antibióticos deve ser agressivo, devido à gravidade do caso, geralmente faz-se uso de uma associação de antibióticos, principalmente em casos de VM prolongada4.
Programas de educação básica tem reconhecido que a ocorrência de PAVM pode ser reduzida em 50% ou mais usando várias intervenções para prevenir a colonização e a aspiração de secreções e de conteúdo gástrico2. O crescimento da freqüência de microorganismos resistentes representa um sério problema de saúde. A UTI é uma grande fonte de patógenos resistentes. Sendo assim, a prevenção deve fazer parte de estratégias de manejo da PAVM. Segundo os autores, deveria ser dada mais atenção para estratégias que definam pacientes de risco para a PAVM, onde estes possam ser tratados em um curto tempo e com terapia única24. A mortalidade desta patologia pode ser reduzida pela identificação dos fatores de risco e da prevenção25.
A seleção de intervenções para um programa de prevenção da PAVM depende da avaliação dos pacientes, dos recursos disponíveis e da habilidade da equipe de saúde de agir em concordância com o programa, para prevenir a ocorrência de colonização do trato aerodigestivo e a aspiração de secreções contaminadas para as VA’s inferiores, que são os dois fatores principais para a patogênese da PAVM5,20.
Uma pesquisa em 4 UTI’s de diferentes hospitais, foi realizada a fim de verificar se um programa de educação preventiva de PAVM é eficaz de diminuir sua ocorrência. O programa era composto de uma apostila com informações sobre a doença, incluindo métodos para reduzir a incidência de PAVM, que foi dada aos fisioterapeutas e enfermeiros intensivistas, além de cartazes informativos e orientações aos profissionais. Avaliou-se a incidência de PAVM 12 meses antes do programa e 18 após o mesmo. Observou-se uma redução estatisticamente significativa, em 3 UTI’s, na incidência da PAVM no período pós-intervenção comparando-se com o pré-intervenção. Os possíveis gastos com esses programas são altamente compensados pela economia devido a menor incidência de PAVM26.
A transmissão cruzada de microorganismos pode ocorrer através de mãos contaminadas da equipe de saúde que manipula os dispositivos invasivos. Sendo assim, evitar a IOT e aumentar a consciência da equipe quanto à higiene das mãos são as maiores medidas para a prevenção da PAVM GIROU.
Outra medida que pode ser adotada para a redução da PAVM é a correta limpeza e esterilização dos aparelhos usados na fisioterapia respiratória como máscaras, fixadores cefálicos, ventilômetros, manovacuômetros, incentivadores respiratórios e outros.
FONTE:http://www.wgate.com.br/conteudo/medicinaesaude/fisioterapia/respiratoria/ventilacao_fabiola.htm
PESQUISA BASEADA EM 

Para progeter os pacientes com a redução dos riscos de IACS, profissionais da saúde devem continuamente atualizar seus conhecimentos sobre o controle de infecções.
Como parte do atual compromisso de tratamentos de saúde de qualidade e controle de infecções, médicos e hospitais em todo o país estão fazendo parcerias com a Kimberly-Clark, promovendo treinamentos em prevenção de infecções hospitalares para suas equipes médicas e administrativas. Embora informar-se a respeito do problema possa parecer simples, ocupadíssimos médicos e enfermeiras nas linhas de frente do atendimento médico podem ter dificuldade de assistir a treinamentos nos hospitais em que trabalham.
O Programa Informativo de IACS é parte de uma campanha nacional de conscientização para profissionais de saúde intitulada “Infecção Aqui Não”, a qual fornece às instituições de saúde um kit com folhetos informativos, dicas de proteção para os pacientes e cartazes.
A campanha “Infecção Aqui Não” provê qualificados programas de educação contínua sobre as práticas ideais, instruções e pesquisas disponíveis para reduzir a incidência de Infecções Associadas aos Cuidados da Saúde.
Para mais detalhes sobre a campanha “Infecção Aqui Não”, consulte www.pt.HAIwatch.com
Sobre a Kimberly-Clark Health Care
A Kimberly-Clark Health Care é provedora de confiáveis soluções em cuidados à saúde, graças a constantes treinamentos, pesquisa clínica e programas educacionais de qualidade.
Nossas soluções ajudam a prevenir, diagnosticar e gerenciar enfermidades nas seguintes áreas: Prevenção à Infecção (Proteção & Controle de Infecção, Pneumonia Associada à Ventilação Mecânica e Infecções do Sítio Cirúrgico), Saúde Digestiva e Controle da Dor. Sobre a Kimberly-Clark Corporation

A Kimberly-Clark e suas reconhecidas marcas mundias são partes indispensáveis da vida em mais de 150 países.
Diariamente, mais de 1,3 bilhão de pessoas – quase um quarto da população miundial – confiam nas marcas da K-C para garantir sua saúde, hygiene e bem-estar.
Com marcas como Kleenex, Scott, Huggies, Pull-Ups, Kotex e Depend, a Kimberly-Clark ocupa a primeira e a segunda posição no setor em mais de 80 países. Para ficar em dia com as notícias mais recentes sobre a K-C e conhecer mais sobre sua trajetória de 137 anos de inovações, visite www.kimberly-clark.com.br
Diariamente, mais de 1,3 bilhão de pessoas – quase um quarto da população miundial – confiam nas marcas da K-C para garantir sua saúde, hygiene e bem-estar.
Com marcas como Kleenex, Scott, Huggies, Pull-Ups, Kotex e Depend, a Kimberly-Clark ocupa a primeira e a segunda posição no setor em mais de 80 países. Para ficar em dia com as notícias mais recentes sobre a K-C e conhecer mais sobre sua trajetória de 137 anos de inovações, visite www.kimberly-clark.com.br







Deixe sua opinião
Obrigado por comentar!
Tenha um dia abençoado e que as bênçãos de Deus sejam sempre frequentes em sua vida! Amém.